Hartnäckige Materie
Biofilm und katheterabhängige Infektionen
Es ist ein Dilemma, dass Wissenschaftler:innen seit Jahrzehnten auf Trab hält: Zentralvenöse Katheter können Leben retten und im selben Zug Leben in Gefahr bringen. Katheterabhängige Blutstrominfektionen zählen nach wie vor zu den häufigsten Ursachen für Krankenhausaufenthalte oder sogar Todesfälle in der Dialyse und parenteralen Ernährung.
Es besteht kein Zweifel, dass solche Infektionen um jeden Preis verhindert werden müssen – aber mit welcher Methode dies am besten funktioniert, ist in Fachkreisen umstritten. So wiesen Austin et al. 2022 erneut auf die anhaltende „Unsicherheit bei der Auswahl von prophylaktischen Wirkstoffen“ hin. (1) Während Wissenschaftler:innen weiterhin unterschiedliche Ansätze verfolgen, taucht eine Variable immer wieder auf: die Korrelation von Infektionen und Biofilm. Unser Artikel nimmt dieses Phänomen genauer unter die Lupe – von den biologischen Mechanismen, die dahinter stecken, bis zu deren Implikationen für effektives Kathetermanagement.
Was ist Biofilm?
Im Fachjargon versteht man unter „Biofilm” eine dünne Schicht aus Mikroorganismen, die sich auf feuchten Oberflächen bildet. In zentralvenösen Kathetern (ZVK) bestehen solche Schichten hauptsächlich aus:
- Bakterien, Pilzen und der von ihnen produzierten Matrix
- Blutbestandteilen und Fibrinablagerungen
- Mineralien und Lipiden
- verabreichten Medikamenten
Eine Akkumulation dieser Substanzen wird früher oder später die Funktionalität des Katheters beeinträchtigen. Zum einen erschwert Biofilm den Blutfluss und verschlechtert somit die Durchlässigkeit. Zum anderen schafft er optimale Voraussetzungen für das Wachstum von infektiösen Keimen.

Warum führt Biofilm zu Infektionen?
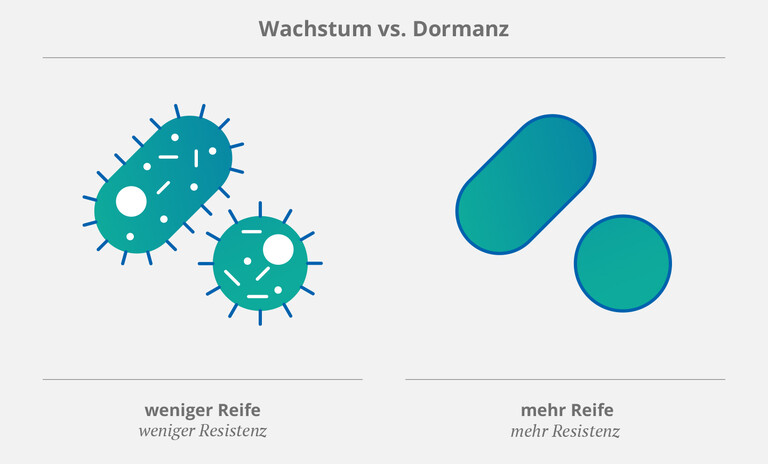
Eine Studie aus dem Jahr 2022 nannte zwei Arten von Bakterien als „häufige oder sogar die häufigsten Ursachen“ für katheterabhängige Infektionen: Gram-negative Escherichia coli (E. coli) und Gram-positive Staphylococcus epidermidis (S. epidermis). (1) Biofilm erleichtert diesen Mikroben nicht nur den Weg in den Katheter – darüber hinaus schützt er sie auch vor körpereigenen Abwehrmechanismen und antimikrobiellen Wirkstoffen. Kurz gesagt: Je mehr Biofilm im Katheter, desto eher werden sich Keime ansammeln und Krankheiten auslösen.
Hinzu kommt, dass Mikroorganismen (wie Bakterien und Pilze) spezielle Strategien entwickelt haben, um unter ungünstigen Bedingungen zu überleben. Eine dieser Strategien besteht darin, das Wachstum einzustellen und sich stattdessen in einen Ruhezustand (die sog. „Dormanz“) zu begeben. (2) So können Pathogene sowohl Angriffen des Immunsystems als auch Antibiotika standhalten. Daher stellen „ruhende“” bzw. „gereifte” (und demzufolge resistentere Bakterien) (3, 4) eine besonders große Bedrohung für Patient:innen mit ZVK dar. In einer Review von 2013 stellten Rittershaus et al. fest, dass diese Art von Pathogenen in einer „relativ hohen Anzahl“ in bakteriellem Biofilm zu finden ist. (2)
Das Problem mit Antibiotika
Dass sich Biofilm so schwer loswerden lässt, liegt in erster Linie an der Vielfalt von Mikroorganismen. Die Suche nach einer Lösung, die alles auf einmal bekämpft, bereitet Wissenschaftler:innen seit Langem Kopfzerbrechen. Denn selbst wenn ein Mittel einige Bakterien tötet, bleiben andere weiterhin im Katheter – und zwar vor allem diejenigen, die sich im besagten Ruhezustand befinden. Traditionell werden meist Antibiotika verschrieben, um gegen katheterabhängige Infektionen vorzugehen. Aber diese Methode ist in vielerlei Hinsicht problematisch:
Antibiotika töten nur eine begrenzte Anzahl an Keimen.
Antibiotika führen dazu, dass der Körper bakterielle Resistenzen ausbildet – wodurch sie mit der Zeit ihre Wirksamkeit verlieren.
Antibiotika haben unerwünschte Nebenwirkungen. Daher sollten sie so wenig wie möglich (und nur wenn unbedingt nötig) eingesetzt werden. (5)
Die Notwendigkeit von präventiven – anstelle von rückwirkenden – Maßnahmen wurde wieder einmal im Rahmen einer Studie zum Management von beschädigten Kathetern deutlich. (6) Über einen Zeitraum von fünf Jahren wurden verschiedene Methoden mit mehr als 140 Patient:innen in der heimparenteralen Ernährung (HPN) getestet. Daraus ergab sich:
- Die Behandlung von bereits infizierten Kathetern mit Antibiotika hatte eine hohe Erfolgsrate.
- Aber: Die Wahrscheinlichkeit, dass diese Katheter im Anschluss eine neue Infektion entwickelten, lag bei 71 %.
Laut Taleb et al. lässt sich dieses Phänomen möglicherweise auf eben jene „ruhenden” Keime zurückführen – also den Teil des Biofilms, den Antibiotika nicht vollständig beseitigen können. (6)

Der antimikrobielle Schlüssel zu infektionsfreien Kathetern
Wie es im Englischen so schön heißt, „prevention is better than cure“. Das gilt vor allem für ZVK, die in der Dialyse, Onkologie oder parenteralen Ernährung zugleich lebensrettend und lebensgefährlich werden können. Katheterabhängige Infektionen ziehen nicht nur kostspielige stationäre Aufenthalte nach sich – sie treiben auch die Mortalitätsrate in die Höhe. (4)
Aber was ist die Alternative zu Antibiotika? Um katheterabhängige Infektionen effektiv zu verhindern, braucht es eine Locklösung, die alle Keime (inklusive derer im Ruhezustand) tötet – und zwar ohne die Entwicklung bakterieller Resistenzen. Genau hier kommt nun Taurolidin ins Spiel:
- Taurolidin ist ein Derivat von Taurin. Taurin ist wiederum eine Aminosäure, die natürlicherweise im menschlichen Körper vorkommt (und häufig für Energy-Drinks verwendet wird). (7)
- Taurolidin hat eine starke antimikrobielle Wirkung gegen mehr als 500 Keime – und zwar auch die, die typischerweise in Katheter-Biofilm zu finden sind (z. B. E. coli und S. epidermis). (8)
- Wenn Taurolidin in den menschlichen Körper gelangt, wird es rasch zu Taurin, Kohlenstoffdioxid und Wasser abgebaut. (7)

Die breite antimikrobielle Wirksamkeit von Taurolidin (ohne unerwünschte Nebenwirkungen) bildet die Basis für alle Locklösungen aus dem TauroLock™-Portfolio. Je nach Bedarf lässt es sich mit verschiedenen aktiven Wirkstoffen kombinieren: Citrat, Heparin und/oder Urokinase. Dabei bleibt das wichtigste Ziel immer gleich: Katheterabhängige Komplikationen (wie z. B. Biofilm) verhindern und somit Patient:innen vor Infektionen schützen.
- Austin et al. Comparative effect of seven prophylactic locks to prevent biofilm biomass and viability in intravenous catheters. J Antimicrob Chemother 2022. DOI: 10.1093/jac/dkac181
- Rittershaus et al. The Normalcy of Dormancy. Cell Host Microbe. 2013 June 12; 13(6): 643–651. DOI:10.1016/j.chom.2013.05.012
- Li et al. Mechanisms and Control Measures of Mature Biofilm Resistance to Antimicrobial Agents in the Clinical Context. ACS Omega 2020, 5, 22684−22690. DOI: 10.1021/acsomega.0c02294
- Hogan et al. In Vitro Approach for Identification of the Most Effective Agents for Antimicrobial Lock Therapy in the Treatment of Intravascular Catheter-Related Infections Caused by Staphylococcus aureus. Antimicrob Agents Chemother 2016. DOI: 10.1128/AAC.02885-15
- Labriola. Antibiotic locks for the treatment of catheter-related blood stream infection: Still more hope than data. Semin Dial 2019. DOI: 10.1111/sdi.12807
- Taleb et al. Effectiveness of salvage catheters in home parenteral nutrition: A single-center study and systematic literature review. Clin Nutr ESPEN 2023. DOI: 10.1016/j.clnesp.2023.04.026
- https://www.taurolock.com/en/about/faq
- Torres-Viera et al. Activities of Taurolidine In Vitro and in Experimental Enterococcal Endocarditis. Antimicrob Agents Chemother 2000. DOI: 10.1128/AAC.44.6.1720-1724.2000


